Displasia Difusa
No se asocia a obstrucción. Los riñones son grandes y esponjosos (Fig.4). La causa es un desarrollo medular deficiente, con elementos ductales dilatados que constituyen los quistes. En los recién nacidos provocan compresión pulmonar y pueden cursar con insuficiencia renal precoz. Por lo general se asocia a síndromes malformativos.
ENFERMEDAD RENAL POLIQUÍSTICA
Enfermedad Renal Poliquística Autosómica Recesiva
Es un trastorno del desarrollo embrionario en la ramificación del sistema tubular del riñón y de los conductos biliares del hígado. Se considera (6) la enfermedad quística renal más frecuente en la edad pediátrica; la incidencia aproximada es de 1/6.000-1/55.000.
Está causada por un defecto genético diferente de la PQRAD. Los padres que no tienen poliquistosis renal, pueden tener un niño con la enfermedad si ambos padres llevan el gen anormal y ambos transfieren el gen a su hijo. La posibilidad de que esto ocurra es de uno a cuatro. Si solo uno de los padres lleva el gen anormal, el niño no podrá tener la enfermedad.
Genética: su carácter de enfermedad autosómica recesiva implica que los padres no están afectados, pero tienen un 25 % de posibilidades de transmitir la enfermedad. Recientemente (5) se ha localizado un gen para esta enfermedad en el brazo corto del cromosoma 6 (región 6p21); no se ha observado hasta el momento heterogeneidad genética.
Biología celular: el tamaño de los quistes es más pequeño que en PQRAD; son derivados desde los túbulos colectores y mantienen contacto con sus nefrones de origen.
Anatomía patológica: se constata un mayor tamaño de los riñones (7) y conservación de la estructura general. Debajo de la cápsula se visualizan múltiples microquistes distribuídos irregularmente. El hígado, también de mayor tamaño, se muestra duro y de superficie lisa. Microscópicamente aparecen dilataciones quísticas recubiertas por un epitelio aplanado. Las lesiones hepáticas son de fibrosis congénita y fibroadenomatosis de las vías biliares.
Modalidades de presentación clínica: Los síntomas de la PQRAR pueden comenzar antes del nacimiento. Los niños con los peores casos mueren a las pocas horas o días de su nacimiento.
La enfermedad afecta el hígado, bazo y páncreas (Fig. 5), y además presenta anemia, venas varicosas y hemorroides. Porque la función renal está disminuida y es crucial para el desarrollo físico temprano, los niños con PQRAR son mas pequeños que la talla normal.
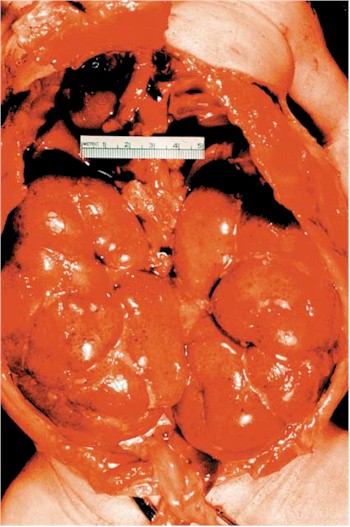
Fig. 5. Poliquistosis renal autosómica recesiva (PQRAR). Los riñones están mostrando in situ que ocupan casi la cavidad abdominal completa de un niño recién nacido. Cistyc diseases of the kidney-Brenner et al.
Modalidades de presentación clínica: Los síntomas de la PQRAR pueden comenzar antes del nacimiento. Los niños con los peores casos mueren a las pocas horas o días de su nacimiento.
La enfermedad afecta el hígado, bazo y páncreas, y además presenta anemia, venas varicosas y hemorroides. Porque la función renal está disminuida (fig. 6) y es crucial para el desarrollo físico temprano, los niños con PQRAR son más pequeños que la talla normal.
La enfermedad renal poliquística autosómica recesiva (PQRAR) se manifiesta clínicamente a cualquier edad (8), suele hacerlo en fases tempranas de la vida (forma perinatal), durante la infancia (forma infantil) o en el transcurso de la adolescencia (forma juvenil). La clínica inicial (9) depende de la edad. Así, en el período de recién nacido aparece como una gran masa abdominal y distrés respiratorio importante. Aunque la insuficiencia renal no es frecuente en esta etapa de la vida, ya se observa hipertensión portal. A partir del primer año (Fig. 7) , la nefromegalia y los signos clínicos de fibrosis hepática se constatan en uno de cada dos pacientes, hipertensión arterial en el 70 % e infección urinaria en el 30 %. Uno de cada cuatro enfermos presenta retraso del crecimiento.
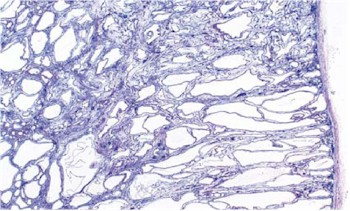
Fig. 6. PQRAR. El examen microscópico muestra los quistes que están agrandando las estructuras tubulares, que llegan de la superficie cortical y se extienden dentro de la medula (H&E, 200).
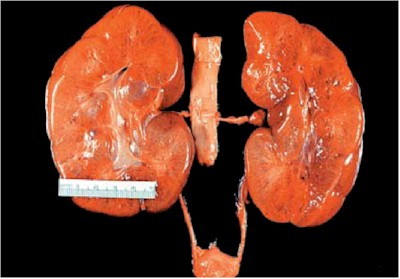
Fig. 7. PQRAR. Corte de la superficie de los riñones que muestra en ambos que la corteza y la médula están completamente reemplazados por una apariencia como esponja. Cistyc diseases of the kidney-Brenner et al.
Diagnóstico: se establece mediante técnicas de imagen, sobre todo la ecografía. En fetos y en recién nacidos permite detectar los quistes renales que no pueden diferenciarse entre PQRAD y PQRAR. También permite detectar la fibrosis hepática en los sujetos afectados y confirmar la normalidad de los progenitores. En situaciones especiales está indicada la biopsia renal y/o hepática. A pesar de ello, el diagnóstico diferencial durante la infancia entre la PQRAD y la PQRAR es muy difícil y sólo el estudio genético molecular es definitivo a este respecto.
Pronóstico: se ha establecido una supervivencia global a los 15 años del 46 %, que alcanza al 79 % si se tienen en cuenta exclusivamente los enfermos que superan el primer año de vida.
Tratamiento: depende de la secuencia de las complicaciones y la insuficiencia renal. El trasplante, una vez instaurada la insuficiencia renal terminal, es el tratamiento de elección.
Enfermedad Renal Poliquística Autosómica Dominante
La enfermedad renal poliquística autosómica dominante (PQRAD) (10) es una enfermedad multiorgánica que se caracteriza por un progresivo crecimiento y desarrollo de los quistes renales que destruyen el parénquima funcional y conducen a la insuficiencia renal crónica terminal a los 40–50 años (Fig. 8).
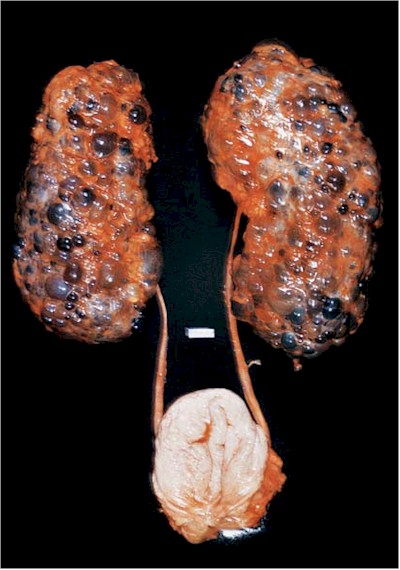
Fig. 8 - Enfermedad poliquística de un adulto. Obsérvese la conservación de la forma normal, la configuración esférica de los quistes y los signos de hemorragia en algunos de los quistes. Cistyc diseases of the kidney-Brenner et al.
Es la enfermedad hereditaria más frecuente (58), ya que el uno por mil de la población es portadora del gen mutante. Afecta a 500.000 personas en Estados Unidos (donde el costo de los cuidados médicos supera los 200 millones de dólares al año) y de 4 a 6 millones en el mundo y representa el 10 % de los pacientes en diálisis. Es rara en África y menos común en negros americanos que en blancos, aunque la incidencia de IRC por PQRAD es similar en negros y blancos.
En el momento actual, no existe tratamiento ni posibilidades de prevención del proceso de formación y crecimiento de los quistes. Es la cuarta causa principal de fallo renal.
Los factores de riesgo (11) para la evolución hacia la enfermedad renal progresiva son: edad temprana del diagnóstico, raza, sexo, anomalías genéticas, episodios de hematuria macroscópica, hipertensión, y aumento del tamaño renal.
Los pacientes diagnosticados antes de los 30 años tienen una sobrevida renal media de 10 años menos que aquellos diagnosticados después de los 30 años.
El crecimiento de los quistes (12) es continuo y cuantificable y se asocia con el fallo renal por compresión del parénquima renal adyacente. Un actual trabajo publicado por el Dr. Jared J. Grantham de la Universidad de Kansas, determinó que cuanto mas grande es el volumen de los riñones, se produce un deterioro más rápido de la función renal. La apoptosis (muerte celular programada) en glomérulos no quísticos y células tubulares, podría jugar un rol importante.
La causa incierta de la progresión acelerada de enfermedad renal en hombres se relacionaría con niveles elevados de testosterona.
Genética: el estudio de Dalgaard (12) en 1957 aclaró el patrón autosómico dominante de la enfermedad. En 1985 se localizó el gen causante de un brazo corto del cromosoma 16.
La enfermedad hereditaria se produce por mutaciones en al menos dos genes. En el tipo I, el gen PKD1 localizado en el cromosoma 16 (16p13.3) es responsable de la enfermedad en el 85 % de las familias (13). En el Tipo II, el gen PKD2 localizado en el cromosoma 4 (4q21-23), se considera responsable de ésta en el 10 % de las familias. La enfermedad hereditaria se produce por mutaciones en al menos dos genes (Tabla 2).
Hay una posible tercera forma no hereditaria asociada con trastornos renales de larga data, diálisis o edad avanzada, no ligada al cromosoma 16 ni al 4. Esta heterogeneidad genética tiene una correspondencia fenotípica: la forma PKD1 es mas grave (edad media en diálisis a los 56 años) que la PKD2 (edad media en diálisis a los 71 años) (Tabla 1).
El gen PKD1, de 46 exones, se extiende sobre 52 k.o. de ADN genómico. La proteína PKD1, la poliquistina, parece implicada en interacciones célula-célula y célula-matriz celular.
Los productos proteicos de estos dos genes, Policistina 1 y Policistina 2, se establecen en el epitelio tubular renal. La Policistina 1 es un receptor de membrana capaz de comprometer e interactuar con muchas proteínas, carbohidratos y lípidos y provocar una respuesta celular a través de canales de fosforilación, mientras se pensó que la Policistina 2 actuaría como un canal permeable al calcio.
En el Tipo I, el gen (58) responsable de ésta en el 10 % de las familias. Hay una posible tercera forma no hereditaria asociada con trastornos renales de larga data, diálisis o edad avanzada, no ligada al cromosoma 16 ni al 4. Esta heterogeneidad genética tiene una correspondencia fenotípica: la forma PKD1 es mas grave (edad media en diálisis a los 56 años) que la PKD2 (edad media en diálisis a los 71 años) (Tabla 1).
El gen PKD1, de 46 exones, se extiende sobre 52 k.o. de ADN genómico. La proteína PKD1, la poliquistina, parece implicada en interacciones célula-célula y célula-matriz celular.
Los productos proteicos de estos dos genes, Policistina 1 y Policistina 2, se establecen en el epitelio tubular renal. La Policistina 1 es un receptor de membrana capaz de comprometer e interactuar con muchas proteínas, carbohidratos y lípidos y provocar una respuesta celular a través de canales de fosforilación, mientras se pensó que la Policistina 2 actuaría como un canal permeable al calcio. Los dos tipos de PQRAD tienen características similares, pero el Tipo II tiene un inicio tardío de los síntomas y un menor grado de progresión al fallo renal; así que los pacientes Tipo II tienen una expectativa de vida mas larga (69 años) que aquellos con Tipo I (53 años). Algunos pacientes con con mutaciones en PKD1 y PKD2 tienen un curso clínico más severo que aquellos con mutaciones en uno solo de los genes (Tabla 1).
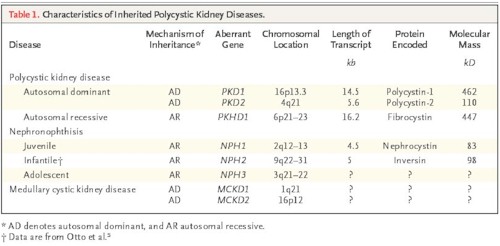
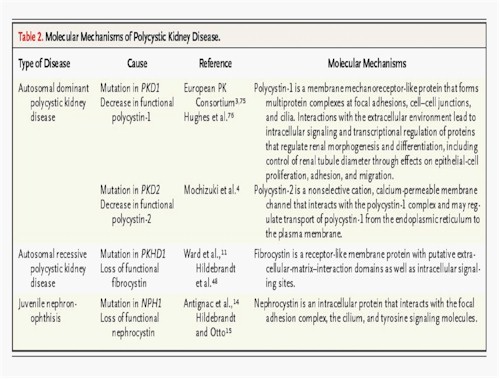
Biología celular: los cientos de quistes esféricos (14) de varios tamaños en todas las partes de la corteza y de la médula son derivados desde todos los segmentos del nefrón n (Fig. 5). La pared tubular que está alineada con una capa simple de células epiteliales se dilata y luego rápidamente al final se cierra (Fig. 9).
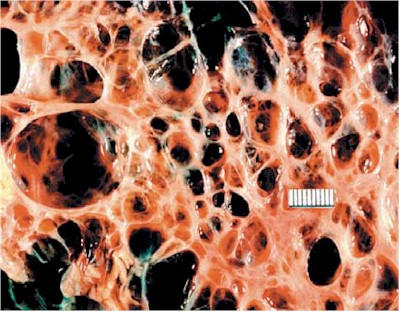
Fig.9. PQRAD. La superficie del corte muestra que los quistes están interpuestos por tejido fibroso. Cistyc diseases of the kidney-Brenner et al.
Proliferación y Apoptosis: un preciso balance controlado entre la proliferación celular y la apoptosis es esencial para el crecimiento normal y la diferenciación del riñón y la estructura renal normal antes del nacimiento. En PQRAR y PQRAD, la apoptosis persiste anormalmente y puede destruir mucho el parénquima renal, permitiendo proliferar al epitelio del quiste.
La importancia de la apoptosis ha sido destacada en las ratas, en quienes la inactivación de los inhibidores de la apoptosis (bcl-2 o AP-2b) causó enfermedad renal quística.
La proliferación de las células del epitelio tubular termina antes del nacimiento, pero la proliferación anormal del epitelio quístico continúa a lo largo de la vida en pacientes con PQRAD (58) (Fig.10).
Sobre todo, el cultivo de células epiteliales de estos pacientes tiene una capacidad intrínseca aumentada para proliferar y sobrevivir. Diversas manipulaciones genéticas que causan proliferación de células epiteliales en ratas solo conducen hacia la enfermedad renal poliquística.
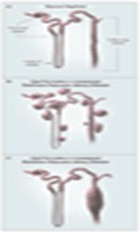
Figura 10. Mecanismos de formación de quistes en PQR.
Los quistes se originan como expansiones del túbulo renal (Panel A). En la PQRAD, los quistes surgen por compresión externa en todo el segmento tubular y rápidamente cierran el nefrón de origen (Panel B). En contraste, en PQRAR, los quistes son derivados de los túbulos colectores, que quedan conectados con el nefrón de origen (Panel C).
El factor de crecimiento epidérmico (EGF) tiene un rol importante en la expansión de los quistes renales. Las células epiteliales de quistes de pacientes con PQRAD y PQRAR no son usualmente susceptibles al estímulo de la proliferación de EGF. Sin embargo, el líquido quístico contiene EGF que es secretado dentro del quiste en una cantidad que puede inducir la proliferación celular.
La sobrecompresión y la posición anormal de los receptores de EGF en la superficie luminar del epitelio quístico adjunto, crean un ciclo sostenido de estimulación hormonal de la proliferación en los quistes (Fig. 2).
Experimentos genéticos en ratas solo han mostrado la importancia de la sobrecompresión de los receptores de EGF en la formación de los quistes renales y este trabajo establece que el desarrollo de inhibidores específicos de EGF-receptor tirosina quinasa podría reducir el número de quistes y prolongar el período de vida de las ratas con enfermedad renal poliquística. Esta clase de inhibidores moleculares pequeños está ahora bajo investigación clínica en fases 1 y 2 en adultos con enfermedad renal poliquística, para determinar si ellos aminoran la expansión de los quistes y disminuyen la función renal.
Los receptores EGF están solo contenidos en las membranas apicales del epitelio de los túbulos colectores en riñones normales de fetos. Por el contrario, los receptores EGF basales en el epitelio de adultos normales son aglomerados de homodímeros, y los son aglomerados de homodímeros, y los receptores EGF apicales consisten en aglomerados de heterodímeros de EGF receptor y erb-b2. La importancia de esta variante de EGF receptor, erb-b2, se destacó por el hecho de la formación de quistes renales en las ratas transgénicas que sobrecomprimen erb-b2 y de que los inhibidores erb-b2 tienen un efecto protector en células in Vitro de pacientes PQRAD. Estas observaciones sugieren que los inhibidores erb-b2 podrían tener valor terapéutico.
Otros factores de crecimiento adicionales, como citoquinas y factores lipídicos, al igual que ATP y AMPc en el líquido quístico, tienen un efecto de proliferación de células epiteliales in Vitro. Estos factores podrían estimular EGF dependiente del crecimiento de los quistes.
Secreción: La reabsorción neta de fluido en el riñón normal es causada por los gradientes de sodio establecidos por la bomba de sodio (NA/K/ATPasa) en las células de las membranas basolateral tubular y por múltiples transportadoras de iones y fluidos y canales en sitios apicales y basolaterales. En los riñones de pacientes con PQR, la bomba NA/K/ATPasa está anormalmente situada en la luz apical de la membrana celular del epitelio tubular y el transportador de NA+, K+ y 2CL- está desplazado a la superficie basal del epitelio.
Otros estudios moleculares de las subunidades alfa y beta del complejo Na/K/ATPasa han mostrado que los riñones normales de adultos contienen complejos alfa 1 beta 1, que están localizados en la región basolateral del túbulo, donde los riñones de pacientes con PQR contienen complejos alfa 1 beta 2 en la membrana apical. En el feto normal, la Na/K/ATPasa está solo compuesta de complejos alfa 1 beta 2 y se establecen en la membrana apical de los túbulos renales. Parece que en PQRAD, un fallo por baja regulación de la transcripción de la isoforma beta 2 después del nacimiento, facilitaría un emplazamiento erróneo de la Na/K/ATPasa en la membrana apical.
La característica adicional del transporte en quistes de la misma familia, incluye la presencia de canales de acuaporina 1 y acuaporina 2 en el epitelio de los quistes y de acuaporina 2 sola en quistes de pacientes con PQRAR. Niveles elevados de ATP liberados por la membrana apical en pacientes con PQRAD podrían favorecer una secreción exacerbada. Los niveles de AMPc intracelular, son también importantes reguladores de la secreción en los quistes y asimismo, de la conductancia transmembrana de la fibrosis quística del regulador de los canales de cloro en la membrana apical del epitelio quístico de pacientes con PQRAD.
Interacciones en la matriz celular: Las anormalidades en la estructura de la membrana basal, la composición de la matriz intersticial, los niveles de metaloproteasas de la matriz y sus inhibidores y la compresión de receptores integrales, ocurren en pacientes con PQR. El engrosamiento de la membrana basal, las alteraciones en la matriz celular y un número anormal de receptores integrales son frecuentes en PQRAD, tanto como en PQRAR y en la Nefronoptisis juvenil. Estas alteraciones causan marcados disturbios funcionales. Por ejemplo, el epitelio de pacientes con PQRAD está más pegado a la matriz formadora de colágeno tipo I o IV, que es del epitelio normal y que ha disminuido su capacidad migratoria contra EGF. Por lo cual, los defectos podrían impedir los movimientos celulares requeridos para la morfogénesis del riñón.
Los experimentos en ratas, han mostrado que la inactivación de varios receptores de adhesión a la matriz y el complejo de adhesión focal asociado con proteínas causa la formación de los quistes.
Polaridad: El nefrón adulto normal es una estructura segmentada alineada por al menos 15 distintos tipos de epitelio altamente polarizado (Fig. 11).
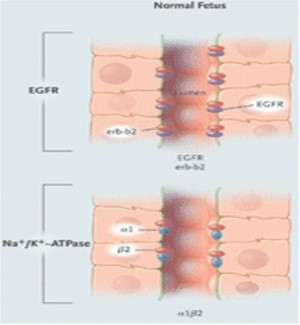
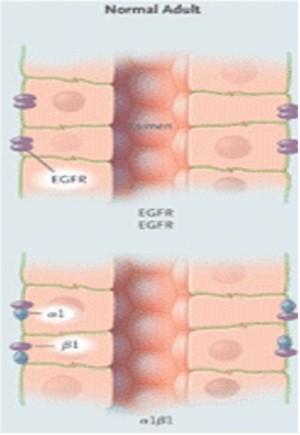
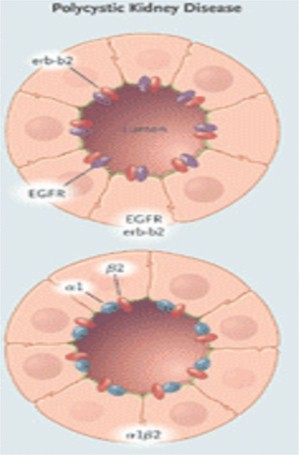
Figura 11. Polarización del Factor Receptor de Crecimiento Epidérmico (EGFR) y Na+/K+–ATPasa en el epitelio de un feto normal, un adulto normal, y un paciente con PQR.
La distribución polarizada de enzimas, iones transportadores, canales, poros, factor de crecimiento y receptores de la matriz, facilitan la función vectorial normal (transporte dirigido) y el control de la división celular, la diferenciación y la maduración. En PQRAD y PQRAR, las alteraciones en la polaridad de las proteínas de la membrana incluyen ubicaciones aberrantes de Na/K/ATPasa, receptores EGF, catepsina B, metaloproteasa 2 de la matriz y caderina E en la membrana basal apical antes que la membrana basolateral. La polarización de las proteínas ocurre durante la maduración de los nefrones en el útero y sigue adelante para significar la interrupción regulada de la compresión genética.

1 comentario:
Buenas tardes Sra Germania
Veo que cuenta con un blog, de muy buena calidad y le agradeceria realizar un intercambio de enlaces
con mi pagina web de tematica SALUD si se encuentra de acuerdo espero su respuesta a mi correo tucontactoweb@gmail.com Gracias.
Publicar un comentario