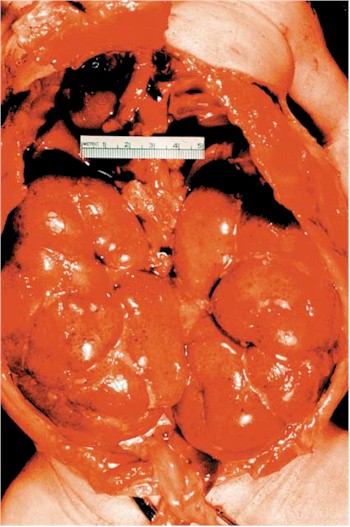
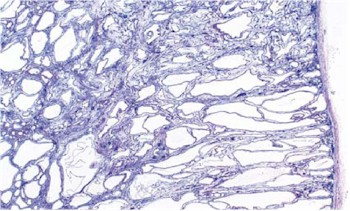
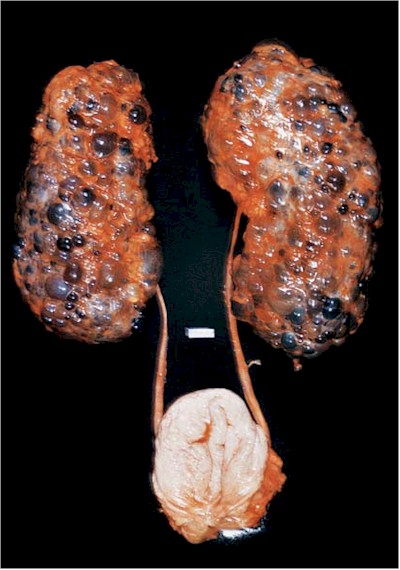
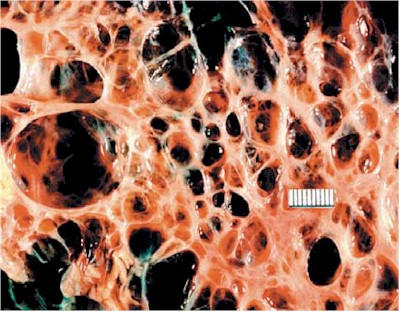
La cirrosis es una afección en la que el hígado se deteriora lentamente y funciona mal debido a una lesión crónica. El tejido sano del hígado se sustituye por tejido cicatricial, bloqueando parcialmente la circulación de la sangre a través del hígado. La cicatrización también deteriora la capacidad del hígado de
- controlar las infecciones
- eliminar las bacterias y las toxinas de la sangre
- procesar los nutrientes, hormonas y medicamentos
- fabricar las proteínas que regulan la coagulación sanguínea
- producir bilis para ayudar a absorber grasas, incluido el colesterol, y vitaminas solubles en grasas
Un hígado sano es capaz de regenerar la mayoría de sus propias células cuando se dañan. En la cirrosis en etapa terminal, el hígado no puede sustituir eficazmente las células dañadas. Se necesita un hígado sano para la supervivencia.
La cirrosis es la doceava causa de muerte por enfermedad, causando 27,000 muertes por año.1 La afección afecta con un poco más de frecuencia a los hombres que a las mujeres.

El hígado y el aparato digestivo.
1Miniño AM, Heron MP, Murphy SL, Kochanek KD. Deaths: Final data for 2004. Centers for Disease Control and Prevention Web site. Actualizado el 10 de octubre de 2007. Fecha de acceso: 20 de enero de 2008.
Ç
¿Qué causa la cirrosis?
La cirrosis tiene varias causas. En los Estados Unidos, las causas más comunes de cirrosis son el consumo abundante de alcohol y la hepatitis C crónica. La obesidad se está convirtiendo en una causa común de cirrosis, ya sea como causa única o en combinación con el alcohol, con la hepatitis C o con ambos. Muchas personas con cirrosis tienen más de una causa de daño hepático.
La cirrosis no es causada por trauma de hígado u otras causas de daño agudo o de corto plazo. Generalmente, años de lesión crónica son necesarios para causar la cirrosis.
Enfermedad hepática relacionada con el alcohol. La mayoría de las personas que consumen alcohol no sufren daño hepático. Pero el consumo abundante de alcohol durante varios años puede causar una lesión crónica en el hígado. La cantidad de alcohol necesaria para provocar daño hepático varía mucho de una persona a otra. En el caso de las mujeres, consumir de dos a tres tragos (incluidos la cerveza y el vino) por día y en el caso de los hombres, de tres a cuatro tragos por día, puede provocar daño hepático y cirrosis. En el pasado, la cirrosis relacionada con el alcohol causaba más muertes que la cirrosis provocada por cualquier otra causa. Las muertes que son consecuencia de la cirrosis relacionada con la obesidad están aumentando.
Hepatitis C crónica. El virus de la hepatitis C es una infección hepática que se transmite por contacto con la sangre de una persona infectada. La hepatitis C crónica provoca inflamación y daño al hígado que con el tiempo puede causar cirrosis.
Hepatitis B y D crónicas. El virus de la hepatitis B es una infección hepática que se transmite por contacto con la sangre, semen u otro fluido corporal de una persona infectada. La hepatitis B, como la hepatitis C, provoca inflamación y lesiones al hígado que pueden provocar la cirrosis. La vacuna contra la hepatitis B se les administra a todos los bebés y a muchos adultos para prevenir el virus. La hepatitis D es otro virus que infecta el hígado y puede provocar cirrosis, pero sólo se presenta en personas que ya tienen hepatitis B.
Enfermedad de hígado graso no alcohólica. En la enfermedad de hígado graso no alcohólica (nonalcoholic fatty liver disease, NAFLD por sus siglas), se provoca un aumento de la grasa en el hígado que finalmente causa la cirrosis. Esta enfermedad hepática cada vez más común está asociada con la obesidad, la diabetes, la desnutrición proteica, la enfermedad de las arterias coronarias y los medicamentos corticoesteroides.
Hepatitis autoinmune. Esta forma de hepatitis es causada por un ataque del sistema inmunitario del cuerpo a las células del hígado, lo que provoca inflamación, daño y finalmente cirrosis. Los investigadores creen que hay factores genéticos que pueden hacer que algunas personas sean más propensas a las enfermedades autoinmunes. Alrededor de un 70 por ciento de las personas con hepatitis autoinmune son mujeres.
Enfermedades que dañan o destruyen las vías biliares. Varias enfermedades pueden dañar o destruir las vías por donde se transporta la bilis desde el hígado, lo que provoca el reflujo de la bilis en el hígado y cause cirrosis. En los adultos, la afección más común de esta categoría es la cirrosis biliar primaria, enfermedad en la que las vías biliares se inflaman y se dañan y, finalmente, desaparecen. La cirrosis biliar secundaria puede presentarse si las vías se atan o lesionan por error durante una cirugía de vesícula biliar. La colangitis esclerosante primaria es otra afección que provoca daño y cicatrices en las vías biliares. En los bebés, el síndrome de Alagille o la atresia biliar, afecciones en las que las vías no existen o están lesionadas, comúnmente provocan daño a las vías biliares.
Enfermedades hereditarias. La fibrosis quística, el déficit de alfa-1-antitripsina, la hemocromatosis, la enfermedad de Wilson, la galactosemia y las glicogenosis son enfermedades hereditarias que interfieren con la forma en que el hígado produce, procesa y almacena enzimas, proteínas, metales y otras sustancias que el cuerpo necesita para funcionar adecuadamente. Estas afecciones pueden causar cirrosis.
Medicamentos, toxinas e infecciones. Otras causas de cirrosis pueden ser las reacciones a medicamentos, la exposición prolongada a químicos tóxicos, las infecciones parasitarias y los ataques repetidos de insuficiencia cardíaca con congestión del hígado.
Ç
¿Cuáles son los síntomas de la cirrosis?
Muchas personas con cirrosis no presentan síntomas en las primeras etapas de la enfermedad. Sin embargo, a medida que la enfermedad avanza, la persona puede experimentar los siguientes síntomas:
- debilidad
- fatiga
- pérdida del apetito
- náuseas
- vómitos
- pérdida de peso
- dolor abdominal e hinchazón cuando se acumula líquido en el abdomen
- picazón
- vasos sanguíneos en forma de araña cerca de la superficie de la piel
¿Cuáles son las complicaciones de la cirrosis?
A medida que la función hepática se deteriora, se puede presentar una o más complicaciones. En algunas personas, las complicaciones pueden ser los primeros signos de la enfermedad.
Edema y ascitis. Cuando el daño hepático pasa a una etapa avanzada, se acumula líquido en las piernas, llamado edema, y en el abdomen, llamado ascitis. La ascitis puede provocar peritonitis bacteriana, que es una infección grave.
Moretones y hemorragias. Cuando se detiene o enlentece la producción de proteínas necesarias para la coagulación sanguínea por parte del hígado, la persona sufre moretones o hemorragias fácilmente.
Hipertensión portal. Normalmente, la sangre se transporta desde los intestinos y el bazo al hígado a través de la vena porta. Pero la cirrosis enlentece la circulación normal de la sangre, lo que aumenta la presión en la vena porta. Esta afección se llama hipertensión portal.
Várices esofágicas y gastropatía. Cuando se presenta la hipertensión portal, puede provocar vasos sanguíneos agrandados en el esófago, llamados várices, o en el estómago, llamado gastropatía, o ambos. Los vasos sanguíneos agrandados tienen más probabilidades de reventarse debido a paredes delgadas y al aumento de presión. Si se revientan, pueden provocar hemorragias graves en el esófago o en la parte superior del estómago, lo cual requerirá atención médica inmediata.
Esplenomegalia. Cuando se presenta la hipertensión portal, con frecuencia el bazo se agranda y retiene glóbulos blancos y plaquetas, disminuyendo el número de estas células en la sangre. Una baja cantidad de plaquetas puede ser la primera prueba de que una persona padece cirrosis.
Ictericia. La ictericia se presenta cuando el hígado enfermo no elimina suficiente bilirrubina de la sangre, lo que provoca una coloración amarillenta de la piel y en el blanco de los ojos, y oscurecimiento de la orina. La bilirrubina es el pigmento que le da a la bilis el color amarillo rojizo.
Cálculos biliares. Si la cirrosis no permite el flujo libre de la bilis desde y hacia la vesícula biliar, la bilis se endurece y se forman cálculos biliares.
Sensibilidad a medicamentos. La cirrosis enlentece la capacidad del hígado de filtrar medicamentos de la sangre. Cuando esto ocurre, los medicamentos actúan por más tiempo de lo normal y se acumulan en el cuerpo. Esto provoca una mayor sensibilidad de la persona a los medicamentos y a sus efectos secundarios.
Encefalopatía hepática. Si el hígado falla, no puede eliminar toxinas de la sangre y finalmente éstas se acumulan en el cerebro. La acumulación de toxinas en el cerebro, llamada encefalopatía hepática, puede provocar una disminución del funcionamiento mental y coma. Los signos de disminución del funcionamiento mental incluyen confusión, cambios de personalidad, pérdida de la memoria, problemas de concentración y cambio en los hábitos de sueño.
Resistencia a la insulina y la diabetes tipo 2. La cirrosis provoca resistencia a la insulina, una hormona producida por el páncreas que le permite al cuerpo usar la glucosa como energía. Con la resistencia a la insulina, los músculos y grasas del cuerpo así como las células del hígado no usan la insulina adecuadamente. El páncreas intenta satisfacer la demanda de insulina produciendo más, pero el exceso de glucosa se acumula en el torrente sanguíneo y causa la diabetes tipo 2.
Cáncer de hígado. El carcinoma hepatocelular es un tipo de cáncer de hígado que puede presentarse en las personas con cirrosis. El carcinoma hepatocelular tiene una tasa de mortalidad alta, pero hay varias opciones de tratamiento disponibles.
Otros problemas. La cirrosis puede causar disfunción del sistema inmunitario, lo que provoca riesgo de infección. La cirrosis también puede causar insuficiencia renal y pulmonar, conocidas como síndrome hepatorrenal y síndrome hepatopulmonar.
¿Cómo se diagnostica la cirrosis?
El diagnóstico de cirrosis generalmente se basa en la presencia de un factor de riesgo para cirrosis, como por ejemplo el consumo de alcohol o la obesidad, y se confirma mediante exámenes físicos, pruebas de sangre e imágenes. El médico preguntará acerca de la historia médica y los síntomas de la persona y realizará un examen físico completo para buscar signos clínicos de la enfermedad. Por ejemplo, en el examen abdominal, el hígado puede sentirse duro o agrandado con signos de ascitis. El médico indicará pruebas de sangre que pueden resultar útiles para evaluar el hígado y aumentar la sospecha de cirrosis.
Para ver en el hígado signos de aumento de tamaño, flujo sanguíneo reducido o ascitis, el médico puede indicar una tomografía computarizada (TC), una ecografía, una resonancia magnética (RM) o una gammagrafía del hígado. El médico puede observar el hígado directamente introduciendo un laparoscopio en el abdomen. El laparoscopio es un instrumento que tiene una cámara que transmite imágenes a un monitor.
El diagnóstico de cirrosis se puede confirmar mediante una biopsia de hígado, pero no siempre resulta necesaria. Generalmente, la biopsia se realiza si el resultado puede tener un impacto sobre el tratamiento. La biopsia se realiza mediante la introducción de una aguja entre las costillas o en una vena en el cuello. Se toman precauciones para minimizar las molestias. Se examina una pequeña muestra de tejido hepático con un microscopio para buscar cicatrices u otros signos de cirrosis. A veces, durante la biopsia se encuentra una causa de daño hepático que no es cirrosis.
¿Cómo se mide la gravedad de la cirrosis?
El modelo para el puntaje de la enfermedad hepática en etapa terminal (model for end-stage liver disease, MELD por sus siglas) mide la gravedad de la cirrosis. El puntaje MELD se creó para predecir la supervivencia de 90 días de personas con cirrosis avanzada. El puntaje MELD se basa en tres pruebas de sangre:
- índice internacional normalizado (international normalized ratio, INR por sus siglas)—evalúa la tendencia de la sangre a la coagulación
- bilirrubina—evalúa la cantidad de pigmento biliar en la sangre
- creatinina—evalúa el funcionamiento de los riñones
Generalmente, el puntaje MELD varía entre 6 y 40, donde un puntaje de 6 indica la mayor probabilidad de una supervivencia de 90 días.
¿Cómo se trata la cirrosis?
El tratamiento de la cirrosis depende de la causa de la enfermedad y si hay complicaciones presentes. Los objetivos del tratamiento son enlentecer el avance del tejido cicatricial en el hígado y prevenir o tratar las complicaciones de la enfermedad. Para la cirrosis con complicaciones, es posible que sea necesaria la hospitalización.
Consumir una dieta nutritiva. Como la desnutrición es común en las personas con cirrosis, es importante consumir una dieta saludable en todas las etapas de la enfermedad. Los proveedores de la salud recomiendan un plan de alimentación bien balanceado. Si se presenta ascitis, se recomienda una dieta baja en sodio. Una persona con cirrosis no debe comer mariscos crudos, los cuales pueden contener una bacteria que causa infecciones graves. Para mejorar la nutrición, el médico puede agregar un complemento líquido que se administre por vía oral o a través de un tubo nasogástrico, un tubo muy pequeño que se introduce por la nariz y la garganta hasta alcanzar el estómago.
Evitar el alcohol y otras sustancias. Se recomienda que las personas con cirrosis no consuman alcohol ni sustancias ilícitas, porque ambas provocarían más daño hepático. Muchas vitaminas y medicamentos, recetados y de venta libre, pueden afectar la función hepática, antes de tomarlos se debe consultar a un médico.
El tratamiento para la cirrosis también trata complicaciones específicas. Para el edema y la ascitis, el médico recomendará diuréticos, los cuales son medicamentos para eliminar líquidos del cuerpo. Se pueden eliminar grandes cantidades de líquido ascítico del abdomen y hacer pruebas de peritonitis bacteriana. Se pueden recetar antibióticos orales para evitar las infecciones. Las infecciones graves con ascitis requerirán antibióticos por vía intravenosa.
El médico puede recetar un betabloqueante o nitrato para la hipertensión portal. Los betabloqueantes pueden disminuir la presión en las várices y reducir el riesgo de hemorragias. Las hemorragias gastrointestinales requieren una endoscopia alta para buscar varices esofágicas. El médico puede realizar una ligadura con una banda utilizando un dispositivo especial para comprimir las várices y detener la hemorragia. Las personas que han tenido várices anteriormente quizás necesiten tomar medicamentos para evitar episodios en el futuro.
La encefalopatía hepática se trata limpiando el intestino con lactulosa, que es un laxante que se da oralmente o mediante enemas. Si es necesario, se agregan antibióticos al tratamiento. Es posible que se les indique a los pacientes que disminuyan el consumo de proteínas en la dieta. La encefalopatía hepática puede mejorar si controlan las otras complicaciones de la cirrosis.
Las personas con cirrosis que presentan insuficiencia hepatorrenal deben someterse a un tratamiento de hemodiálisis periódico, el cual utiliza una máquina para limpiar los desechos de la sangre. Además, se administran medicamentos para mejorar el flujo sanguíneo a través de los riñones.
Otros tratamientos atienden las causas específicas de la cirrosis. El tratamiento para la cirrosis causada por hepatitis depende del tipo específico de hepatitis. Por ejemplo, para la hepatitis viral se recetan interferón y otros medicamentos antivirales, la hepatitis autoinmune requiere corticoesteroides y otros medicamentos que deprimen el sistema inmunitario.
Se administran medicamentos para tratar varios síntomas de la cirrosis, como por ejemplo la picazón y el dolor abdominal.
¿Cuándo se indica un trasplante de hígado para la cirrosis?
Se considera la posibilidad de un trasplante de hígado cuando no se pueden controlar las complicaciones mediante tratamiento. El trasplante de hígado es una operación importante en la que se extirpa el hígado enfermo y se reemplaza por uno sano de un donante de órgano. Un equipo de profesionales de la salud determina los riesgos y beneficios del procedimiento para cada paciente. En los últimos años las tasas de supervivencia han mejorado como consecuencia de los medicamentos que suprimen el sistema inmunitario y evitan que este ataque dañe el hígado nuevo.
El número de personas que necesita un trasplante de hígado supera ampliamente el número de órganos disponibles. Una persona que necesita un trasplante debe someterse a un complejo proceso de evaluación antes de ser agregado a una larga lista de espera para trasplantes. Generalmente, los órganos se les dan a las personas que tienen posibilidades de vivir más tiempo después del trasplante. La supervivencia después de un trasplante requiere un seguimiento intensivo y colaboración por parte del paciente y del proveedor de atención medica.
Puntos por recordar
- La cirrosis es una afección en la que el hígado se deteriora lentamente y funciona mal debido a una lesión crónica. El tejido normal sano del hígado se sustituye por tejido cicatricial, evitando que el hígado funcione como debería.
- En los Estados Unidos, las causas más comunes de cirrosis son el consumo abundante de alcohol y la hepatitis C crónica. La obesidad se está convirtiendo en una causa común de cirrosis, ya sea como causa única o en combinación con el alcohol, con la hepatitis C o con ambos. Muchas personas con cirrosis tienen más de una causa de daño hepático.
- Entre otras causas de cirrosis están la hepatitis B, la hepatitis D y la hepatitis autoinmune; enfermedades que dañan o destruyen las vías biliares, enfermedades hereditarias, la enfermedad de hígado graso no alcohólica y medicamentos, toxinas e infecciones.
- Muchas personas con cirrosis no presentan síntomas en las primeras etapas de la enfermedad. A medida que la enfermedad avanza, los síntomas pueden incluir debilidad, fatiga, pérdida del apetito, náuseas, vómitos, pérdida de peso, dolor abdominal e hinchazón, picazón y vasos sanguíneos en forma de araña cerca de la superficie de la piel.
- A medida que la función hepática se deteriora, se puede presentar una o más complicaciones. En algunas personas, las complicaciones pueden ser los primeros signos de la enfermedad.
- Los objetivos del tratamiento son detener el avance del tejido cicatricial en el hígado y prevenir o tratar las complicaciones.
- El tratamiento para la cirrosis incluye evitar el alcohol y otras drogas, terapia nutricional y otras terapias que tratan complicaciones específicas o causas de la enfermedad.
- Para la cirrosis con complicaciones, es posible que sea necesaria la hospitalización.
- Se considera la posibilidad de un trasplante de hígado cuando no se pueden controlar las complicaciones de la cirrosis mediante tratamiento.
Esperanza a través de la investigación
La Division of Digestive Diseases and Nutrition del National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), que en español se llama Instituto Nacional de la Diabetes y las Enfermedades Digestivas y Renales, apoya la investigación básica y clínica de enfermedades hepáticas, incluida la cirrosis, y el trasplante de hígado. Los investigadores también están estudiando
- los mecanismos para revertir la cirrosis en las primeras etapas de la enfermedad
- posibles nuevos enfoques del tratamiento de las complicaciones de la cirrosis
- el resultado a largo plazo de los nuevos medicamentos para tratar la hipertensión portal
- el desarrollo de terapias para prevenir y tratar la reaparición de la hepatitis C después del trasplante de hígado